~人工光合成の実現へ大きな一歩~
◆発表のポイント
- 光合成では、光化学系 II[1]と呼ばれる膜タンパク質複合体が光エネルギーを利用して、水分子から酸素分子を生成しています。
- フェムト秒 X 線自由電子レーザー[2]を用いて、光化学系 II の“ゆがんだイス”型の触媒が水分子を取り込み、酸素分子生成の準備が完了するまでの一連の動きを捉えることに成功しました。
- 本研究成果は、光合成で水分子から水素イオンと電子を取り出す仕組みの解明だけでなく、光で水を分解するための人工光合成触媒の設計にも重要な指針を提供するものです。
光合成は、光化学系 II が光エネルギーを利用して水分子から電子と水素イオンを取り出し、酸素を形成する反応から始まります。岡山大学異分野基礎科学研究所の沈建仁教授、菅倫寛教授は、東北大学多元物質科学研究所の南後恵理子教授(理化学研究所放射光科学研究センター チームリーダー)、高輝度光科学研究センターの大和田成起主幹研究員(理化学研究所放射光科学研究センター 客員研究員)、兵庫県立大学大学院理学研究科の久保稔教授らと共同で、光化学系 II の結晶に可視光を当てて反応を開始させた後に、X 線自由電子レーザー施設 SACLA [3]のフェムト秒 X線を用いて、光化学系 II の“ゆがんだイス”型の触媒が水分子を取り込み、酸素分子生成の準備が完了するまでの一連の動きの立体構造をナノ秒(1 ナノ秒は 10 億分の 1 秒)からミリ秒の時間スケールで捉えることに成功しました。その結果、光化学系 II の内部では、タンパク質、水分子、集光色素などがオーケストラのように協奏的に働き、水の移動や水素イオンの排出を進行させることがわかりました。この働きによって運動性が高まった水分子が、触媒に過渡的に結合した後、その内部へと取り込まれていく様子が初めて観測されました。これらの結果は、光合成において酸素分子が形成される反応の仕組みを明らかにするものです。特に、酸素の材料となる水分子が、いつ、どこを通って触媒まで到達するのか、という疑問に答えるものです。本研究成果は、英国時間 1 月31 日午後 4 時(日本時間 2 月 1 日午前 1 時)、英国科学誌「Nature」に掲載されます。
本研究で明らかになった酸素分子を形成する仕組みは、光エネルギーを利用して水から電子と水素イオンを取り出して有用な化学物質を作り出す「人工光合成[4]」の技術を開発するための重要な知見を与えると期待されます。
◆研究者からひとこと


■発表内容
<現状>
植物や藻類が太陽の光エネルギーを利用して水と大気中の二酸化炭素から糖を合成し、酸素分子を放出する反応は、光合成として知られています。光合成は、光化学系 II と呼ばれる、約 20 個のタンパク質とクロロフィル、カロテノイドなどの集光色素からなる複合体が光エネルギーを吸収して効率よく利用し、水分子から電子と水素イオンを取り出して酸素分子を形成する反応から始まります。光化学系 II が反応を触媒する詳細な仕組みを解明し、人工的に利用することができれば、光エネルギーを利用して、水から電子と水素イオンを取り出し、有用な化学物質を作り出す「人工光合成」の技術開発にもつながると期待されています。
光化学系 II は、光エネルギーを利用して非常に安定な水分子から電子と水素イオンを取り出す反応を温和な条件下で触媒する巨大な膜タンパク質複合体です。これまで沈教授、菅教授らのグループは光化学系 II の高い品質の結晶を用いて、放射光施設 SPring-8 の強力な X 線や、X 線自由電子レーザー施設 SACLA の強力な X 線パルスにより、その構造を 2011 年および 2015 年にそれぞれ解析して、水分子を分解する触媒部分の正体はマンガン(Mn4CaO5)クラスターで“ゆがんだイス”の形をしていることを英国科学誌「Nature」に報告してきました(図 2)。触媒が“ゆがんだイス”の形をしているのはタンパク質の内部に存在しているためであり、S 状態と呼ばれる反応サイクルの途中で触媒の形が変化して酸素分子を形成するためと考えられています。沈教授、菅教授らは2017年および 2019 年に S3や S2状態と呼ばれる反応中間体や酸素分子を形成する直前の状態の構造を解析し、基質である水分子を取り込んだ後の触媒の様子を捉えることに成功し、英国科学誌「Nature」と米国科学誌「Science」にそれぞれ報告してきました。
わたしたちが普段目にしている世界を高速カメラで見ると、全く違うものに見えることはよくあることです。例えばドライブレコーダーの映像では LED 信号機の光が点滅しているように見えます。これと同じで、これまでの解析は触媒に水分子が取り込まれた後の「準安定」な姿を捉えたものであり、その途中に何が起こっていたのかはわかりませんでした。従って、反応の途中に酸素の材料となる水分子がいつ、どこを通って触媒まで到達するのかも不明でした。また巨大なタンパク質の内部をとても小さな電子が高速で移動する瞬間や、化学結合が形成される瞬間において、タンパク質がどのように動く(振る舞う)のかということは一般的によくわかっていません。しかし、持続時間が数十フェムト秒(1 フェムト秒は 1000 兆分の 1 秒)の X 線自由電子レーザーの X 線パルスを用いれば、タンパク質の動きを高速カメラのように捉えることが可能となります。
<研究成果の内容>
沈教授、菅教授らの共同研究グループは、「時間分解シリアルフェムト秒結晶構造解析法[5]」を微小なサイズの光化学系 II の結晶に適用し、ポンプ-プローブ実験を行いました。光化学系 II の結晶に可視光のレーザー閃光を 1~2 発照射すると、水を分解する反応サイクルが S1状態から S2~S3状態と呼ばれる状態に進みます。ここでレーザー閃光に引き続いてナノ秒からミリ秒の一定時間経過後に X 線自由電子レーザーを照射すれば、次の状態に進行している瞬間に相当する動的構造の X 線データを取得することができます。今回の実験では、光化学系 II が光を吸収して、次の状態の形成が始まる 20 ナノ秒から、その形成が終結する 5 ミリ秒までの時点の立体構造を 6 つ(20 ナノ秒、200 ナノ秒、1 マイクロ秒、30 マイクロ秒、200 マイクロ秒、5 ミリ秒)(1 マイクロ秒は 100 万分の 1 秒)捉えることに成功しました。さらに S1 状態から S2 状態に進む時の構造変化と、S2 状態から S3状態に進む時の構造変化をそれぞれ解析することで、反応サイクルの S 状態の違いによる影響も調べました(図 3)。この実験では全部で 14 個の立体構造のスナップショットを得て解析しました。
これにより、巨大な光化学系 II の内部では、電子の流れに呼応して、タンパク質、水分子、集光色素などがオーケストラのように協奏的に働き、ドミノ倒し的に相互に作用を伝えることで、水の移動や取り込み、水素イオンの排出が進行する様子が観測されました。また、これらの働きによって運動性の高くなった水分子が、“ゆがんだイス”の中のカルシウムイオンに過渡的に結合した後に、触媒内部へと取り込まれていく様子が初めて観測されました。
<社会的な意義>
光化学系 II にある“ゆがんだイス”の形をした触媒は、周期的な 5 つの中間状態を経て、極めて高い効率で反応を行っています。本研究は、光合成の酸素分子が形成される反応に欠かせない構造基盤を明らかにするものです。
本研究の成果により、これまで謎であった、酸素分子が形成されるために必要な詳細な過程が明らかとなりました。これは、太陽の光エネルギーを利用して水分解反応を人工的に実現する触媒の設計に重要な情報を提供するものです。この反応を模倣する「人工光合成」が実現すれば、太陽の光エネルギーを利用して水から電子と水素イオンを取り出し、有用な化学物質を高効率・低コストで作り出すことが可能となります。このような「人工光合成」の技術は、エネルギー問題、環境問題、食糧問題を解決しうる重要なものであると期待されています。
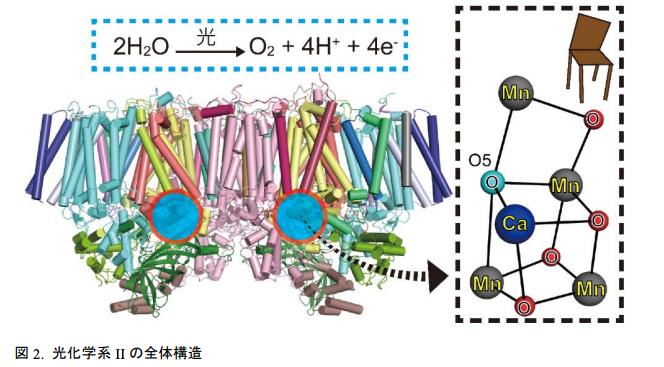
全 20 個のタンパク質からなる複合体が 2 つ集合して 1 つの構造をとり、水分子から水素イオン(H+)と電子(e-)を取り出して酸素分子を形成する反応を触媒する。赤丸で囲んだ部分に反応を進行させる触媒があり、これは右側に拡大するようにゆがんだイス型のマンガンクラスターである。
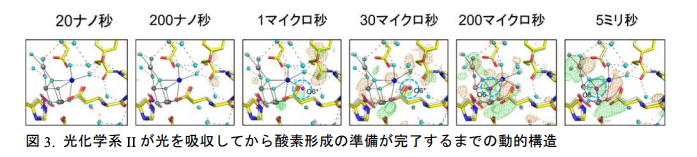
光化学系 II の特別なクロロフィルは光を吸収すると励起して電子を放出する。その後、特別なクロロフィルは触媒から電子を 1 つ受け取り、反応は次のステップに進む。この図は反応サイクルの S2状態と呼ばれる段階から酸素形成の直前の段階であるS3状態に変化するまでの動的構造を表している。ゆがんだイス型の触媒は 200 ナノ秒の速い段階では何も変化が起きないが、1 マイクロ秒になると水の経路から運ばれた水分子 O6*(水色破線)がカルシウムイオン(青色)に一時的に結合する。この水分子 O6*は 200 マイクロ秒から 5 ミリ秒の間になくなってしまうが、同じタイミングでO6 と呼ばれる酸素原子(水色破線)が触媒に出現し、O6*が O6 の位置に移動したことを示している。触媒中の O5 と O6 は酸素分子を形成するのにちょうどよい位置関係にあり、次のステップで酸素形成が行われることを示唆している。図中の緑色と赤色のメッシュは電子密度の変化(立体構造の変化)を表しており、緑色はプラス(新たに出現したもの)、赤色はマイナス(時間に伴い、元の状態から減ったもの)を意味している。
■論文情報
論文名:
“Oxygen-evolving photosystem II structures during S1-S2-S3 transitions”
「酸素発生サイクル S1-S2-S3遷移での光化学系 II の構造」
掲載紙:Nature
著者:
Hongjie Li, Yoshiki Nakajima, Eriko Nango, Shigeki Owada, Daichi Yamada, Kana Hashimoto, Fangjia Luo, Rie Tanaka, Fusamichi Akita, Koji Kato, Jungmin Kang, Yasunori Saitoh, Shunpei Kishi, Huaxin Yu, Naoki Matsubara, Hajime Fujii, Michihiro Sugahara, Mamoru Suzuki, Tetsuya Masuda, Tetsunari Kimura, Tran Nguyen Thao, Shinichiro Yonekura, Long-Jiang Yu, Takehiko Tosha, Kensuke Tono, Yasumasa Joti, Takaki Hatsui, Makina Yabashi, Minoru Kubo, So Iwata, Hiroshi Isobe, Kizashi Yamaguchi, Michihiro Suga*, Jian-Ren Shen*
DOI:10.1038/s41586-023-06987-5
URL:https://www.nature.com/articles/s41586-023-06987-5
*責任著者:岡山大学異分野基礎科学研究所 菅倫寛教授、沈建仁教授
■研究資金
本研究は、日本学術振興会・科学研究補助金「特別推進研究」(課題番号:JP22H04916)、「新学術領域研究(研究領域提案型)」(課題番号:JP17H06434、JP19H05777、JP19H05784、JP20H05446、JP22H04754)、「基盤研究 B」(課題番号:JP20H03226、JP23H02450)、科学技術振興機構(JST) 戦略的創造研究推進事業 個人型研究(さきがけ)(課題番号:JPMJPR18G8)、日本医療研究開発機構・創薬等先端技術支援基盤プラットフォーム(課題番号:JP21am0101070)等の支援を受けて実施しました。
■補足・用語説明
注 1:光化学系 II
光合成反応では光化学系 II と光化学系 I と呼ばれる 2 つの膜タンパク質複合体がクロロフィルで受け取った光のエネルギーを効率よく利用して、光化学系 II は水から電子と水素イオンを取り出す反応を、光化学系 I は糖を合成するのに必要な強力な還元力を供給する反応を触媒する。
注 2:X 線自由電子レーザー(XFEL)
X 線自由電子レーザーとは、X 線領域におけるレーザーのこと。従来の半導体や気体を発振媒体とするレーザーとは異なり、真空中を高速で移動する電子ビーム(自由電子)を媒体とするため、原理的な波長の制限はない。また、数フェムト秒(1 フェムト秒は 1,000 兆分の 1 秒、光が約 0.3µm しか進まない時間)の超短パルスを出力する。XFEL は X-ray Free Electron Laser の略。
注 3:X 線自由電子レーザー(XFEL)施設 SACLA
理化学研究所と高輝度光科学研究センターが共同で建設した日本の XFEL(X-ray Free-Electron Laser)施設。2006 年度から 5 年間の計画で建設・整備を進めた国家基幹技術の 1 つ。2011 年 3 月に完成し、SPring-8 Angstrom Compact free-electron LAser の頭文字を取って SACLA(サクラ)と命名された。2011 年 6 月に最初の X 線レーザーを発振、2012 年 3 月から共用運転が開始され、その際光化学系 II は最初の実験ターゲットとして選ばれている。SPring-8 の 10 億倍明るい X 線を、10 フェムト秒未満のパルス時間内で提供する。強い X 線のために照射を受けた試料は破壊されてしまうが、照射時間が短いため、試料の損傷によるタンパク質の構造変化が起こる前に回折像を撮影することができる。その結果、X 線の損傷を受けていないタンパク質の立体構造を決定することができる。
注 4:人工光合成
光合成を人為的に行う技術のこと。ほぼ無尽蔵に供給される太陽光を利用して、地球上に豊富にある水を分解して水素ガスやその他の有用化合物を作ることができる。地球温暖化に対する環境負荷が大きい二酸化炭素の放出を伴わない、あるいは二酸化炭素を他の有用な化合物に変換することができるので、クリーンで再生可能なエネルギー源として注目されている。
注 5:時間分解シリアルフェムト秒結晶構造解析法
多数の結晶を交換しながら X 線自由電子レーザーを照射して部分的な X 線回折データを回収して構造解析するシリアルフェムト秒結晶構造解析方法を、反応を開始してから一定の時間経過後(今回は 20 ナノ秒から 5 ミリ秒)に行って構造解析する方法。これにより一定の時間経過後のタンパク質の動的な構造が見えるため、反応の進行する様子を動画のように理解することができる。
<研究に関するお問い合わせ>
岡山大学異分野基礎科学研究所
教授 菅 倫寛(すが みちひろ)
(電話番号)086-251-7877
教授 沈 建仁(しん けんじん)
(電話番号)086-251-8502
出典:
https://www.okayama-u.ac.jp/up_load_files/press_r5/press20240201-1.pdf
記事の追加及び削除:
記事の追加あるいは削除を希望される場合、お手数ではございますが、以下窓口までご連絡ください。
info@symphotony.com
この情報へのアクセスはメンバーに限定されています。ログインしてください。メンバー登録は下記リンクをクリックしてください。

