2023年7月12日
ポイント
- 500 nLの微量サンプルに含まれる約1,000個~1万個のナノサイズ細胞外小胞を5分で計測
- 複雑な工程で検出に数時間を要していた超遠心分離機※1での工程を省略可能に
- 細胞間コミュニケーションの革新的な解析や、がんを含むさまざまな疾患の早期診断に貢献
概要
大阪公立大学 研究推進機構 協創研究センター LAC-SYS研究所の飯田 琢也所長、床波 志保副所長、中瀬 生彦所長補佐ら研究チームの藤原 佳奈氏(2023年3月大阪府立大学大学院理学系研究科博士前期課程修了)と高木 裕美子研究員らは、がん細胞由来のナノ粒子である細胞外小胞※2と抗体修飾ビーズの反応をレーザー光照射下で生じる光の力※3で加速。得られた集積体の立体構造を共焦点光学システム※4を利用して解析しました。その結果、わずか500 nLのサンプル中に含まれる約1,000個~1万個のナノサイズ細胞外小胞(従来法の4,000分の1に相当)を5分以内に計測できることを実証しました(従来法は数時間必要)。今回の研究では大腸がん細胞と肺がん細胞から分泌されたナノサイズ細胞外小胞を計測し、数時間の複雑な工程を要する超遠心分離工程を省略できる可能性も示しました。この成果は、がんを含むさまざまな疾病のマーカーとして期待されている細胞外小胞のハイスループット計測につながるものであり、超早期診断における全く新しい基盤技術を提供するものです。
本研究成果は、2023年7月12日(水)午後6時、「Nanoscale Horizons」にオンライン掲載される予定で、さらに同誌のOutside Front Coverにも採用されました(2023年7月24日発行のissue 8に掲載予定)。

研究の背景
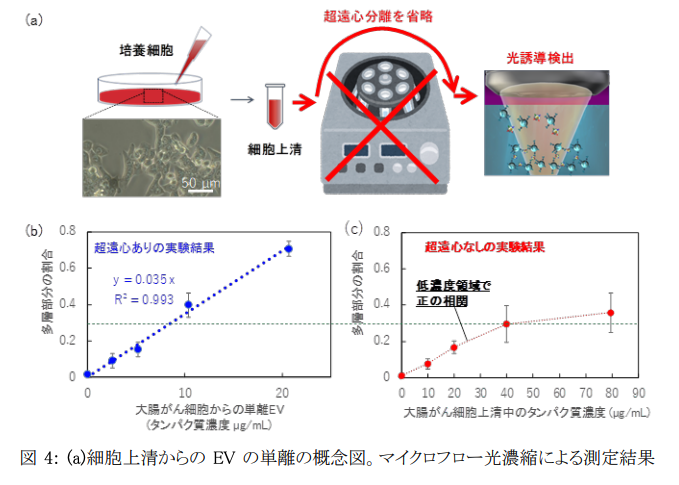
ヒト細胞を含む生体細胞は、さまざまな小胞構造から構成されており、エクソソームやエクトソームなどのナノスケールの細胞外小胞(EV)は、細胞間コミュニケーションのために細胞外に分泌されます。エクソソームを含む直径50~150 nmのナノスケールEVは、細胞間コミュニケーションの担い手の一つとしてだけでなく、細胞由来のmicroRNA、mRNA、タンパク質などを含むことから、さまざまな疾患のバイオマーカーやドラッグデリバリーのカプセルとしても注目されています。そのため、微量試料からナノスケールEVを迅速かつ高感度に検出することは、がんやアルツハイマー病などの難治性疾患の早期診断に特に有用であると考えられます。しかしながら、細胞上清からエクソソームなどのナノスケールEVを抽出するには、数時間の複雑な工程を要する超遠心分離を行う必要がありました。
本研究チームの従来の光濃縮検出研究では、光の力で捕捉した金属ナノ粒子集合体の発熱効果による対流でDNAの二重鎖形成の光誘導加速に成功しており(T. Iida, et al., Sci. Rep. 2016)、さらに抗原抗体反応のマイクロフロー光誘導加速によるタンパク質の微量検出にも成功しています(T. Iida, et al., Commun. Biol. 2022)。しかし、エクソソームなどのナノスケールEVは光の波長より小さく、光圧の作用も弱いだけでなく発熱効果による対流を用いた場合には熱的ダメージも懸念され、微量検出にこれらの方法論が使えるかどうかはこれまで不明でした。また、夾雑物を多く含む細胞上清に適用できるかどうかも未解決の重要課題でした。
研究の内容
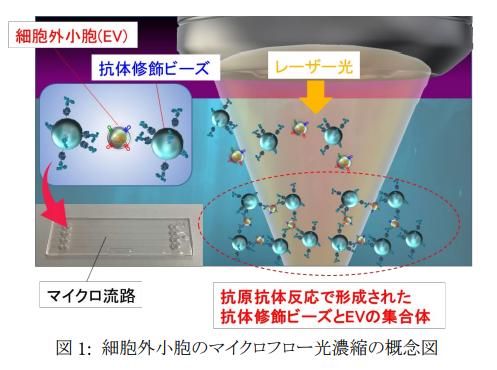
本研究では、大腸がん細胞株および肺がん細胞株から分泌されたEVを標的として、それぞれのEV表面の複数種類の膜タンパク質の各々と特異的に結合する抗体を修飾した直径2 μmのビーズを幅100 μm程度のマイクロ流路中に一定流量で導入し、レーザー照射により生じる光圧による濃縮・集積化を行いました(図1)。さらに、マイクロフロー光濃縮により形成された抗体修飾ビーズとEVの集積構造の光学透過像を観察し、全集合面積に対する多層部分(黒色部分)の面積の割合を、レーザースポット位置を変えて測定し(図2(a))、スポット位置65 μm下方の時が最も高い直線性が得られることを確認しました(図2(b)はこの条件での透過像)。さらに、同じスポット位置で共焦点光学システムを用いて3次元解析を行ったところ、EV量と立体的な集積構造の側面から見た場合の面積もEV濃度と正の相関を示すことを明らかにしました。これらの結果は、レーザースポット位置を変化させることで光誘起力の強さを変調し、検量線の直線性と誤差を制御できる可能性も示しています(図2(a))。
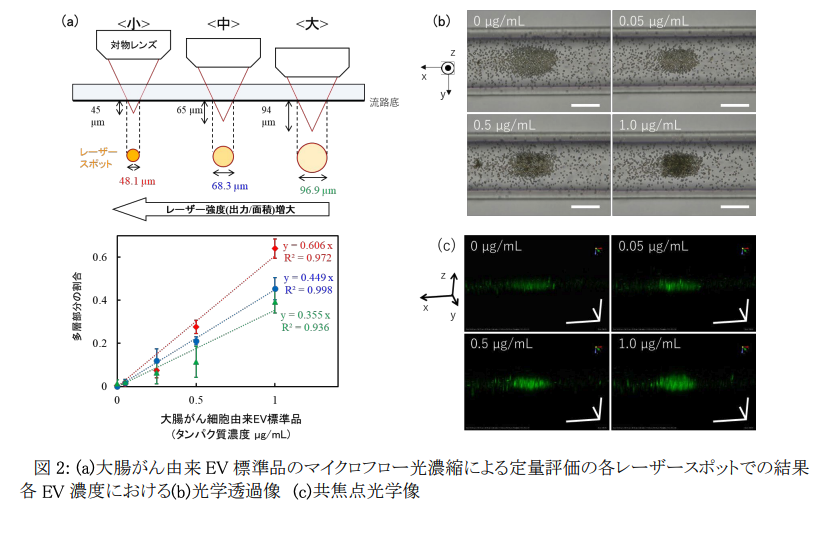
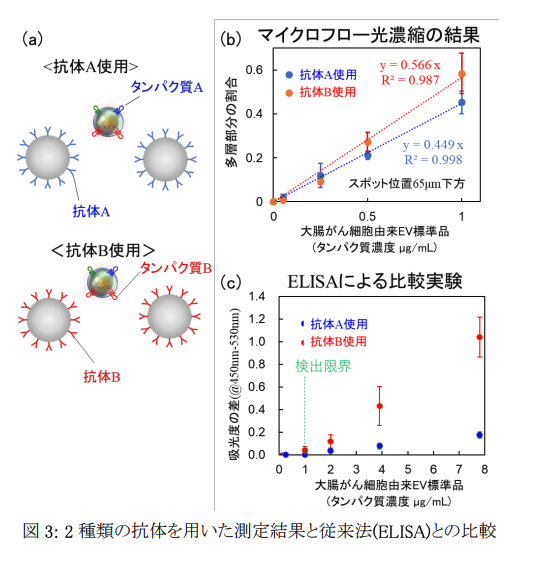
本研究手法は、従来法であるELISA※5よりも1~2ケタの高感度化に成功し、500 nLの液体試料中のわずか103-104個のナノスケールEVを5分以内に検出することに成功しました。さらに、EV表面の膜タンパク質に特異的に結合する2種類の抗体修飾ビーズを用いて、大腸がん細胞由来EVのマイクロフロー光濃縮検出したところ、各EV表面の膜タンパク質の種類と発現量を検量線から識別できる可能性も示唆しました(図3)。
本研究では、数時間かかる超遠心分離工程を必要とせず、生きたがん細胞株から分泌されるEVを高い直線性の検量線を取得して特異的に検出することに成功しました(図4)。さらに、デフォーカスしたレーザーを用いた光の力の作用範囲を調整することで、検出範囲を制御することができ、多層構造形成のプロセスについて理論計算との対応も確認しました。
本研究では、飯田所長、床波副所長、中瀬所長補佐が共同で研究を開始し、研究デザインに貢献しました。藤原佳奈氏(飯田研で2023年修士取得)、高木裕美子研究員(飯田研研究員)、飯田所長、床波副所長はEVの光濃縮の実験を実施しました。また、藤原氏と高木研究員はELISAによる比較実験を行いました。藤原氏、大村美香氏(中瀬研現M2)、森本健太氏(中瀬研で2023年修士取得)、中瀬所長補佐が培養細胞株からのEV抽出とナノポア計測を行いました。田村守特任講師と飯田所長は光濃縮の理論計算を実行しました。
期待される効果・今後の展開
本研究成果は、超高速・高感度・定量的な生体ナノ粒子計測の手法を提供するものであり、将来的に細胞間コミュニケーションの革新的な解析や、がん・炎症・免疫等を含むさまざまな疾患の早期診断の基盤となる技術を提供するものです。
また、光圧の作用範囲を変化させることで、数多くの生物学的ナノ粒子の超高速・高感度な定量計測を可能にし、従来法の複雑さに伴う検出効率や操作時間のボトルネックを克服することができます。
今回明らかにした大腸がん細胞株や肺がん細胞株由来のナノスケールEVだけでなく他の種類のがん細胞にも適用可能です。さらに、認知症マーカータンパク質がEVに含まれるとの報告もあり(C. Z. J. Lim, et al., Nature Commun., 10, 1144 (2019).など)、認知症マーカー検査にも本技術が適用できる可能性や、EVと同サイズのウイルスなどへの適用可能性も期待できます。
資金情報
本研究はJST未来社会創造事業「低侵襲ハイスループット光濃縮システムの開発 (JPMJMI18GA、JPMJMI21G1)」(研究開発代表者:飯田琢也)、JST創発的研究支援事業「バイオミメティック電極による外場誘導型エコシステムの創成(JPMJFR201O)」(研究代表者:床波志保)、科研費基盤研究(A)(17H00856、21H04964)(研究代表者:飯田琢也)、大阪府立大学キープロジェクト(「LAC-SYSプロジェクト ―次世代バイオフォトニクスが拓く未来―」)などの支援の下で実施されました。
用語解説
※1 超遠心分離機:
遠心分離機の中でも超高速回転に最適化され、重力加速度(9.8 m/s2)の100万倍の加速度(106 G)を生み出す装置。分子生物学、生化学、高分子科学で用いられることが多く、分離用と分析用がある。従来、エクソソームなどナノスケールのEVを単離・生成するには超遠心分離機が必要であった。
※2 エクソソーム、エクトソーム:
直径100 nm程度のナノスケールな細胞外小胞(extracellular vesicle、EV)のことを指す。テトラスパニンと呼ばれる4つの膜貫通ドメインを持つ膜タンパク質によって特徴付けられ、これらのタンパク質に抗体を選択的に結合させる分析方法を使用して検出することが可能。エクソソームは細胞内で産生されて細胞外に分泌されるのに対し、エクトソームは細胞膜が出芽してできるEV(直径はエクソソームより大きく数百nm程度)である。エクソソーム、エクトソームはともに、細胞間コミュニケーションを担う生物学的ナノ粒子として、内外にタンパク質や核酸などを保持し、医療検査用のマーカーやドラッグ・デリバリーシステムの医薬品キャリアとしても注目されている。
※3 光の力:
光誘起力のことで、光が物質に及ぼす電磁気学的な力の総称。直進するレーザー光を物質に照射すれば、「押す」力を与えることができ、レンズで強く絞ったレーザー光の強度の強いスポット付近に物質を捕捉することができる。
※4 共焦点光学システム:
主に蛍光イメージングに基づく顕微鏡観察において、高解像度かつ3次元情報の再構築を可能とする光学系のこと。検出装置の手前に配置したピンホールにより、焦点の合っている位置から発せられる蛍光以外の光を遮断し、立体的な試料の観察において従来の顕微鏡よりも鮮明な蛍光スライス像を取得し、それらを重ね合わせて次元像を再構築できる。
※5 ELISA:
酵素結合免疫吸着法(enzyme-linked immunosorbent assay)。抗体を修飾したプレート上に検出対象物質と酵素標識した抗体を含む液体試料を滴下後、静置と洗浄を繰り返し、選択的に抗体に結合した検出対象物質を光吸収により測定する。 計測に5~6 時間必要。
掲載誌情報
【発表雑誌】
英国王立化学会(RSC) Nanoscale Horizons (Impact factor = 11.7)
【論文名】
Ultrafast Sensitivity-Controlled and Specific Detection of Extracellular Vesicles Using Optical Force with Antibody-modified Microparticles in a Microflow System
【著者】
Kana Fujiwara, Yumiko Takagi, Mamoru Tamura, Mika Omura, Kenta Morimoto, Ikuhiko Nakase, Shiho Tokonami and Takuya Iida
【掲載URL】
https://doi.org/10.1039/d2nh00576j
研究内容に関する問い合わせ先
大阪公立大学
大学院理学研究科/LAC-SYS研究所
教授/所長:飯田 琢也(いいだ たくや)
TEL:072-254-8132
E-mail:t-iida[at]omu.ac.jp
准教授/副所長:床波 志保(とこなみ しほ)
E-mail:tokonami[at]omu.ac.jp
教授/所長補佐:中瀬 生彦(なかせ いくひこ)
E-mail:i-nakase[at]omu.ac.jp
[at]を@に変更してください
報道に関する問い合わせ先
大阪公立大学 広報課
TEL:06-6605-3411
E-mail:koho-list[at]ml.omu.ac.jp [at]を@に変更してください
該当するSDGs

出典:
https://www.omu.ac.jp/info/research_news/entry-06898.html
記事の追加及び削除:
記事の追加あるいは削除を希望される場合、お手数ではございますが、以下窓口までご連絡ください。 info@symphotony.com
この情報へのアクセスはメンバーに限定されています。ログインしてください。メンバー登録は下記リンクをクリックしてください。