<ポイント>
◇光誘導加速※1により、がん治療に有用な分子を濃縮し、狙った細胞内に導入。
◇細胞内小器官※2の染色試薬を従来の1000分の1の濃度で狙った細胞に導入し、染色。
◇細胞死を起こす薬剤を従来の100分の1の濃度で狙ったがん細胞に導入し、破壊。

<概要>
大阪公立大学 研究推進機構 協創研究センターLAC-SYS研究所の中瀬 生彦 所長補佐、飯田 琢也 所長、床波 志保 副所長らの研究チームは、がん治療に有用な生物機能性分子を細胞内導入する際の光誘導加速に関する新技術の基礎構築に成功しました。
本研究ではわずか100秒のレーザー照射による光発熱効果で発生した対流(光誘起対流)を駆使し、細胞表面に輸送・濃縮した生物機能性分子の選択的な生化学反応を光誘導加速して、有用な分子を従来よりも 100〜1000分の1の低濃度で細胞内に濃縮導入できることを実証し、その機構解明につながる重要な知見を獲得しました(図1)。特に、数百pmol/L(p(ピコ):10-12)レベルの低濃度条件下でもミトコンドリア検出試薬などの低分子を細胞内の小器官に選択的に導入することに成功しました。さらには数十 nmol/L(n(ナノ):10-9)レベルの低濃度の抗がん活性ペプチド(R8-PAD)をがん細胞内に濃縮導入し、狙った細胞群のアポトーシス(細胞死の一種)を誘発することにも成功しました。
本研究成果により、低濃度薬剤をターゲット病原細胞に選択的に導入することによる副作用低減のための知見獲得や、高価な新薬の細胞試験における薬剤量大幅削減による開発コストの低減が可能となり、創薬プロセスの期間短縮や開発費抑制にもつながると期待されます。
本研究成果は、2022年12月16日(金)(日本時間)、「Nano Letters」にオンライン掲載されます。

<研究の背景>
細胞膜は細胞の恒常性を維持するためのバリアであり、ペプチド、タンパク質、核酸などの生物学的機能分子を細胞内に送り届けます。特定の細胞内小器官に生物機能性分子を到達させて細胞機能を操作するためには細胞膜透過が必要不可欠です。たとえば、がん細胞を細胞死の一種であるアポトーシスなどで死滅させるためにも細胞膜透過の効率を向上させる必要があります。従来の細胞内取込のプロセスにはエンドサイトーシス※3などさまざまなプロセスがありますが、いずれも数μmol/L~数十μmol/L(μ(マイクロ):10-6、)と高濃度の生物機能性分子が必要であり、また低い細胞膜透過性のために狙った細胞内小器官に生物機能性分子を到達する確率が低く薬物活性が低いことが問題視されています。現在、細胞膜透過性を高め、細胞内へ高効率に送達可能な運搬体をつくる研究開発が盛んに行われています。しかし、細胞膜を通過し細胞内へ効果的に機能分子を送り届けるためには、数十μmol/L 程度のペプチド濃度が必要でした。
加えて、細胞選択性が乏しいことで、がん細胞だけでなく正常な細胞へのダメージも避けられず、狙った細胞のみへの投与を高効率に行う技術構築が必要であり、副作用を避けるために低濃度の薬剤を狙った病原細胞に選択的に導入する技術の開発が切望されていました。また、選択的な細胞機能制御による薬効評価の高効率化が実現できれば、個々の細胞と薬剤の相性を調べる手法開発を加速することができ、創薬・医療分野の発展も期待されます。
<研究の内容>

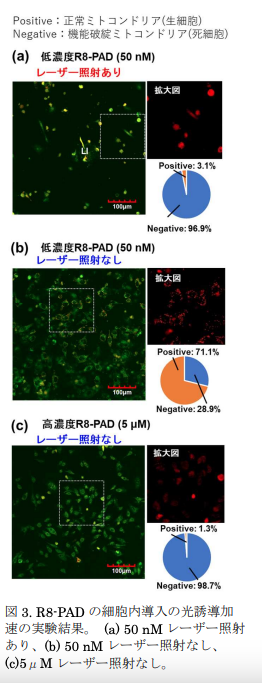
本研究では、超放射の補助による光誘起対流を用いて、細胞透過性ペプチド(CPP)を含む生体機能性分子の細胞膜への集積と透過性向上を実現し、1000分の1程度のnmol/L(10-9モル/リットル)レベルでの光誘起集合のドラッグデリバリーシステムへの応用を実証しました(図 1~図3)。細胞培養液中の生細胞の周りに光発熱集合を誘起するために、プラズモニック超放射※4を示す高密度に金ナノ粒子を固定したガラスボトムディッシュ※5、または金薄膜をコーティングしたガラスボトムディッシュに生体にほとんど吸収されずダメージを与えない波長1064nmの赤外レーザー(出力:100 mW~400 mW)を10倍対物レンズで100秒間集光し、基板上の細胞から100μmほど離れた位置にある目的の生細胞付近に分子を濃縮しました。細胞内小器官であるミトコンドリアだけを染色するMitoTrackerという低分子を用いた実験では、従来の自然の細胞内導入では500nmol/L以上必要であり、図2のレーザー照射点から離れた場所での比較実験結果から100分の1に相当する5 nmol/Lや1000分の1に相当する500pmol/Lのように低濃度ではほとんど細胞内に入らずミトコンドリアを染色できていないことが分かります。一方でレーザー照射点付近の実験結果では、わずか1000分の1の濃度である500pmol/Lでも光誘起バブル近傍の細胞内のミトコンドリアだけを選択的に染色できることを明らかにしました(図 2)。
さらに、光誘導加速により従来法よりも100分の1の濃度に相当する50n mol/LのR8-PADを用いてアポトーシスへの誘導に成功し(図 3)、非常に効率的で選択的な細胞内への取り込みと狙ったがん細胞の破壊に成功しました。
<期待される効果・今後の展開>
細胞への取り込み、細胞膜への浸透、細胞質輸送を極低濃度の標的分子により効率的に行える革新的な技術を提供する本研究成果は、細胞への薬効評価の高効率化や副作用の低減などに関する新たな知見を与えるものです。本研究成果により、高価な新薬の細胞試験における薬剤量を大幅に削減して低コスト化や創薬プロセスの加速にもつながることが期待されます。たとえば、選択的な細胞機能制御や薬効評価、個々の細胞と薬剤の相性をハイスループット(自動的かつ高速に細胞への薬剤活性などを評価)に調べる手法の提供やプレシジョン・メディスン(精密医療)やテーラーメード医療など創薬・医療分野へのブレークスルーを与え得るものです。現在、本研究成果の基礎部分の発明も特許査定を受けており、製薬メーカーなどとの産学連係での研究開発も進めていきます。
<資金情報>
本研究は JST 未来社会創造事業「低侵襲ハイスループッ ト光濃縮システムの開発(JPMJMI18GA、JPMJMI21G1)」(研究開発代表者:飯田琢也)、科研費基盤研究(A)「ホウ素中性子捕捉療法(BNCT)におけるテーラーメード型癌腫標的薬剤の創製研究」(16H02612)(研究代表者:中瀬生彦)、「多種生体サンプルを標的としたオンデマンド光誘導加速システムの創成」(17H00856)(研究代表者:飯田琢也)JST 創発的研究支援事業「バイオミメティック電極による外場誘導型エコシステムの創成(JPMJFR201O)」(研究代表者:床波志保)、大阪府立大学キープロジェクト(「LAC-SYSプロジェクト ―次世代バイオフォトニクスが拓く未来―」)などの支援の下で実施されました。
<用語解説>
※1 光誘導加速:
大面積に光の力や光誘起対流を発生させて生体分子間の衝突確率を飛躍的に高めて分子認識を高効率に引き起こすこと。
※2 細胞内小器官:
細胞の内部で分化した形態や機能を持つ構造の総称であり、たとえば、核、小胞体、ゴルジ体、エンドソーム、リソソーム、ミトコンドリアなどが例として挙げられる。本研究で対象としたミトコンドリアは脂質二重層から成る外膜と内膜を有しており、さまざまなタンパク質を膜に有している。また、電子と酸素分子を利用してATPを合成することが知られており、細胞死の一種であるアポトーシスでも重要な役割を担う。
※3 エンドサイトーシス:
細胞外の分子などを細胞が取り込む過程の1つである飲食作用のことを指す。分子の種類によっては極性を持ちサイズが大きいものがあるが、これらは疎水性の細胞膜を通り抜ける事ができないため、細胞表面の受容体に分子を結合した後、膜変形によりこれらの分子を取り込む過程のことをエンドサイトーシスと呼ぶ。
※4 プラズモニック超放射:
金属はその内部を電子が自由に走り回ることができるため高い導電性や金属光沢を示すことは良く知られている。一方で、金属から成る100ナノメートル(nm:ナノメートルは100万分の1ミリメートル)以下のサイズのいわゆる金属ナノ粒子では内部の表面近傍に束縛された自由電子が「局在表面プラズモン」と呼ばれる状態を形成する。金属ナノ粒子が高密度に集積すると、各粒子中の局在表面プラズモンが光電磁場を介して相互作用することで光散乱効率が高まると同時にスペクトル幅が増大し、分極間相互作用による長波長シフトも起こる。
例えば、可視域に含まれる500~600ナノメートルに共鳴波長を有する金ナノ粒子が高密度に集積した場合には、赤外波長のレーザーに対する散乱だけでなく吸収も増大することを、これまでの理論研究で明らかにしている。
※5 ガラスボトムディッシュ:
細胞培養用の小型容器で中心付近に直径 12mm 程度の小さな円形の
1 mm 程度の深さの窪みがあり、その部分に細胞と培養液を保持できる。
<掲載誌情報>
【発表雑誌】
Nano Letters
【論 文 名】
Light-induced condensation of biofunctional molecules around targeted living cells to accelerate cytosolic delivery
【著 者】
Ikuhiko Nakase, Moe Miyai, Kosuke Noguchi, Mamoru Tamura, Yasuyuki Yamamoto, Yushi Nishimura, Mika Omura, Kota Hayashi, Shiroh Futaki, Shiho Tokonami and Takuya Iida
【掲載 URL】
https://doi.org/10.1021/acs.nanolett.2c02437

【JST 事業に関する問い合わせ先】
科学技術振興機構 未来創造研究開発推進部
小泉 輝武(こいずみ てるたけ)
TEL:03-6272-4004
E-mail:kaikaku_mirai[at]jst.go.jp
出典:
https://www.jst.go.jp/pr/announce/20221216/pdf/20221216.pdf
記事の追加及び削除:
記事の追加あるいは削除を希望される場合、お手数ではございますが、以下窓口までご連絡ください。
info@symphotony.com
この情報へのアクセスはメンバーに限定されています。ログインしてください。メンバー登録は下記リンクをクリックしてください。

